| 标识符 | CSTR: 16397.09.0I01001077 |
|---|---|
| 资源中文名称 | 心肌组织特异性Meox1过表达转基因小鼠 |
| 资源英文名称 | B6.Tg(a-MHC-Meox1)-GC/ILAS |
| 疾病概述 | 肥厚型心肌病(hypertrophic cardiomyopathy, HCM)在病理上有三个特点,分别是心肌肥大、心肌细胞排列紊乱和间质纤维化。引起家族性肥厚型心肌病的分子机制主要是基因缺陷,占发病的50% ,其病理生理机制,主要包括肌小节蛋白基因突变引起的收缩力产生缺陷;细胞骨架蛋白基因突变引起的收缩力传递缺陷;ATP调节蛋白基因突变引起的心肌能量不足;以及改变的Ca2 可利用性和 改变的肌纤维C 敏感性引起的Ca2 内稳态异常。 |
| 实验动物背景信息 | C57BL/6 |
| 模型制作方法 | 小鼠Meox1基因插入心脏特异表达的 a-MHC启动子下游,构建Meox1转基因表达载体,用显微注射法将线性化的转基因表达载体注射到C57BL/6J小鼠的受精卵中。
|
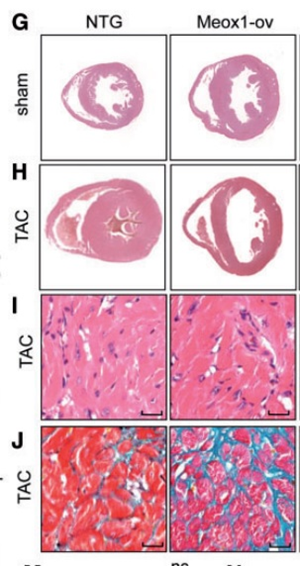
| 模型表型数据 | 通过超声影像(包括反映内径长度变化的参数左室收缩末期内径(LVEDD)及左室收缩末期内径(LVESD),反映后壁厚度的参数舒张末期左室后壁厚度(LVPWD)及收缩末期左室后壁厚度LVPWS,反映左室收缩功能的参数左室短轴缩短率(LVFS))和病理组织学(H&E染色显微水平和透射电镜超微水平)分析,在整体,显微和超微水平观察心脏功能和结构形态的改变,发现Meox1于心肌组织特异性过表达,可引起心肌肥厚表型,此外,在病理刺激情况下,包括遗传性和手术诱导的压力负荷刺激,Meox1于心肌组织特异性过表达可加速模型小鼠心肌肥厚的失代偿进程,分析指标包括超声影像相关参数、病理组织学分析、生存率分析、心肌肥厚标志物水平(心钠肽和脑钠肽)及心重比等。随后,在分子水平,通过信号转导和体外反向验证分析,即包括RNAseq、启动子活性分析、染色质免疫沉淀及细胞内反向验证,发现其病理机制,即Meox1主要通过下游靶分子Gata4来参与心肌肥厚失代偿进程的。
|
| 动物模型的评价与验证 | 心肌肥厚小鼠模型 |
| 保存方式 | 冷冻 |
| 合作方式 | 不限定 |
| 相关文章 | DanLu,JizhengWang,JingLi,FeifeiGuan,XuZhang,WeiDong,NingLiu,ShanGao,LianfengZhang;Meox1 accelerates myocardial hypertrophic decompensation through Gata4. Cardiovascular Research (2018)114,300–311. |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号