| 标识符 | CSTR:16397.09.0C01000767 |
|---|---|
| 资源中文名称 | H7N9禽流感病毒感染小鼠模型 |
| 资源英文名称 | H7N9 avian influenza virus infected murine model |
| 疾病概述 | 人类上呼吸道组织和气管主要分布有唾液酸α-2,6 型受体(人流感病毒受体);人类肺组织分布有唾液酸α-2,3 型受体(禽流感病毒受体)和唾液酸α-2,6型受体。H7N9禽流感病毒可以同时结合唾液酸α-2,3 型受体和唾液酸α-2,6 型受体,但H7血凝素与唾液酸α-2,3 型受体亲合力更高,较季节性流感病毒更容易感染人的下呼吸道上皮细胞,病毒可持续复制,重症病例病毒核酸阳性可持续3周以上。 H7N9 禽流感病毒感染人体后,可以诱发细胞因子风暴,如干扰素诱导蛋白10(IP-10)、单核细胞趋化蛋白-1、白细胞介素6和8(IL-6,IL-8) 等,导致全身炎症反应,可出现急性呼吸窘迫综合征(ARDS) 、休克及多器官功能障碍综合征(MODS) 。病理检查显示肺急性渗出性炎症改变,肺出血、弥漫性肺泡损伤和透明膜形成等。 |
| 实验动物背景信息 | BALB/c为近交系小鼠,遗传背景一致,微生物背景可控,个体间相似度高,易于操作;小鼠相关的免疫球蛋白、细胞类型、细胞因子等试剂己商品化,费用和饲养要求低。此外,H7N9病毒直接感染的BALB/c小鼠,感染模型主要表现为下呼吸道感染,重症肺炎,肺部病理学损伤类似人感染后的严重病例,甚至导致小鼠死亡。所以BALB/c小鼠可作为研究流感病毒致病性、传播力及传播机制的主要动物模型之一。 |
| 模型制作方法 | 1. 实验环境 生物安全实验室3级:参照2013年4月2日卫计委专家对新发甲型H7N9禽流感病毒生物安全评估会议指南暂定H7N9禽流感病毒属于二类。将H7N9禽流感生物危害等级定位Ⅲ级。已被我国列为按甲类传染病管理的乙类传染病,对其病原体和动物感染实验的操作应该在ABSL-3实验室中进行。 独立通风笼(IVC) 2. 实验材料 1)毒株:H7N9毒株(A/Anhui/1/2013); 2)实验动物:SPF 雌性4-6周龄BALB/c小鼠; 3)试剂:DMED培养液,RNeasy Mini Kit(QIAGEN,74106)等 4)实验仪器: 微型离心机(EASTWIN6000) 高速冷冻离心机(KUBOTA3500) 电动研磨器(德国IKA-T10) 倒置显微镜(Nikon) 实时荧光定量检测系统(ABI) 二氧化碳培养箱(Thermo371) 生物安全柜 3. 实验操作规程 |
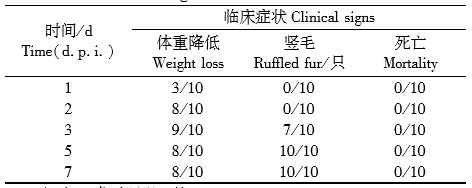
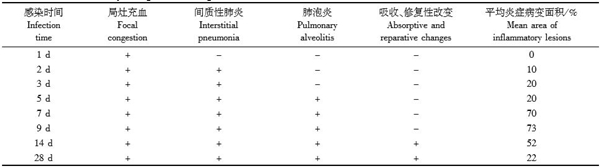
| 模型表型数据 | 小鼠感染H7N9模型指标和结果 BALB/c小鼠攻毒后第1天开始活动减少、拒食、竖毛等现象出现。3d开始出现死亡。RT-PCR检测结果显示肺组织中存在大量H7N9病毒;病毒分离结果显示小鼠病毒在小鼠体内的复制高峰期时第2~6天。解剖可观察道小鼠肺实变,表面呈暗红色。病理学改变表现为局部支气管黏膜上皮欢死、脱落,黏膜炎细胞浸润明显,肺泡腔内有渗出,肺间隔内轻度增宽,为重度间质性肺炎。
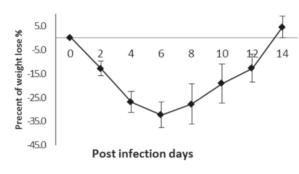
106 TCID50 H7N9 (A/Anhui/1/2013)攻毒后小鼠体重变化率。数据为两次独立实验的均值。 Percentage initial weight loss in mice infected with 106 TCID50 of H7N9 (A/Anhui/1/2013). Data are presented as the average values from two independent experiments ± SD (n =10 per group).
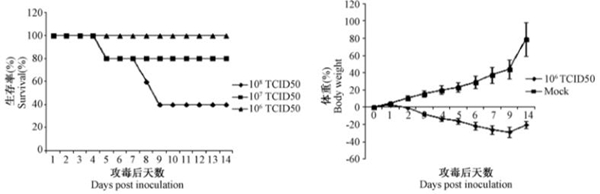
H7N9病毒感染后小鼠存活率和体重减轻情况 Survival rate and body weight changes of the mice inoculated with H7N9 virus
小鼠感染后临床症状 Clinical signs in the mice
小鼠感染后病毒载量结果 Replication of H7N9 virus in the mice
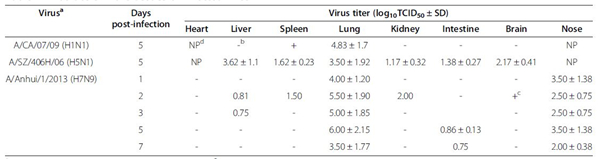
H7N9感染小鼠组织中病毒载量 Virus titers in the tissues of H7N9 infected mice 注:a鼠以106TCID50剂量感染。b在MDCK中传代三次仍检测不到病毒。c可观察到细胞病变,但TCID50值小于0.5。dNP,不显示。 Note: aMice were infected with influenza viruses at a dose of 106 TCID50.bViable virus was not detected after three passages in MDCK cells. cCyotpathic effects were observed but TCID50 values were less than 0.5.dNP, Not performed.
小鼠肺部炎症变化情况 Inflammatory changes of the lungs in the mice inoculated with H7N9 virus 注:平均炎症病变面积为每只小鼠病变面积的平均值 Note: Mean inflammation area=mean value of the inflammation area of all mice in a group
(A) 小鼠肺组织的HE染色 (100×倍). (B) 通过免疫组化标示的组织中H7N9分布. 感染后第3天,病原使用棕色标记 (400×倍). (A) Hematoxylin and eosin stain (HE) staining of lung tissues from infected mice (100× magnification). (B) Distribution of H7N9 viruses in the tissues of infected mice as determined by IHC. Representative viral antigen distribution in tissues at 3 dpi is shown. Viral antigens are marked with brown (400× magnification). |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 |
Bao L, Xu L, Zhu H, et al. Transmission of H7N9 influenza virus in mice by different infective routes[J]. Virology Journal, 2014, 11(1):185. Chen Z, Wang J, Bao L, et al. Human monoclonal antibodies targeting the haemagglutinin glycoprotein can neutralize H7N9 influenza virus[J]. Nature Communications, 2015, 6:6714. Wang J, Chen Z, Bao L, et al. Characterization of Two Human Monoclonal Antibodies Neutralizing Influenza A H7N9 Viruses[J]. Journal of Virology, 2015, 89(17):JVI.01295-15. Shuran Gong, Feifei Qi, Fengdi Li, Qi Lv, Guanpeng Wang, Shunyi Wang, Jing Jiang, Lin Wang, Linlin Bao, Chuan Qin. Human-Derived A/Guangdong/Th005/2017 (H7N9) Exhibits Extremely High Replication in the Lungs of Ferrets and Is Highly Pathogenic in Chickens. Viruses 2019, 11(6), 494. 陈霆, 鲍琳琳, 朱华, et al. 新型禽源人流感病毒(H7N9)的小鼠感染模型和传播模型建立[J]. 中国比较医学杂志, 2014(1):52-55. 吕琦, 鲍琳琳, 许黎黎, et al. 季节性流感疫苗对小鼠感染H7N9禽流感病毒的保护效力[J]. 中国实验动物学报, 2014, 22(1):44-47. 邓巍, 李彦红, 朱华, et al. BALB/c小鼠和雪貂感染H7N9禽流感病毒后的肺组织动态病理学变化[J]. 中国实验动物学报, 2014, 22(1):13-17. 朱华, 许黎黎, 鲍琳琳, et al. H7N9禽流感病毒小鼠感染动物模型的建立[J]. 中国实验动物学报, 2014(1):18-21. 吕琦, 鲍琳琳, 许黎黎, et al. 季节性流感疫苗免疫血清与H7N9禽流感病毒交叉反应[J]. 中国比较医学杂志, 2014(1):59-61. 李枫棣, 鲍琳琳, 朱华, et al. H7N9禽流感病毒在小鼠体内的适应性[J]. 中国比较医学杂志, 2014(1). 鲍琳琳, 朱华, et al. 新型H7N9病毒在同居小鼠中的传播途径[J]. 中国实验动物学报, 2014, 22(1):27-31. |
| 备注 | 需在生物安全实验室内构建,目前相关技术和SOP保存于中国医学科学院医学实验动物研究所感染性疾病研究平台,该平台可提供相应技术支持和服务 |




 京公网安备 11010502043083号
京公网安备 11010502043083号