| 标识符 | CSTR:16397.09.0C01000746 |
|---|---|
| 资源中文名称 | 重症登革热小鼠模型 |
| 资源英文名称 | |
| 疾病概述 | 登革热(Dengue fever, DF)是一种由登革病毒(Dengue virus, DENV)引起的急性传染病,是全球传播最广泛的蚊媒传染病之一。患者可在感染后1~14天,多数在5~9天后发作。症状包括发热、皮疹、头痛、肌肉和关节痛等。少数患者病情可进一步恶化,发生危及生命的重症登革热(包括登革出血热和登革休克综合征),出现严重休克和出血,可在1~2天内因出血性休克或中枢性呼吸衰竭而死亡。登革热流行于全球热带及亚热带地区,尤其是在东南亚、太平洋岛屿和加勒比海等100多个国家和地区。随着世界气候变化及国际交往的增多,我国各省均有输入病例报告,广东、云南、福建、浙江、海南等南方省份可发生本地登革热流行,因此,登革热成为威胁我国人民健康安全的重要传染病之一。 |
| 实验动物背景信息 | 小鼠模型是登革病毒感染及登革热发病机制研究的重要工具。科研人员最初使用登革病毒临床分离株颅内感染正常小鼠,感染效果差,且出现麻痹等神经症状,不适合建立动物模型。之后,鉴于干扰素的抗登革病毒作用,研究者利用缺乏IFN-ɑ/β、IFN-γ受体的AG129小鼠构建登革病毒感染模型,但存在一定程度的免疫抑制,限制了该模型的应用。然后,为建立免疫完整性更高的小鼠模型,使用交替传代病毒株感染I型干扰素受体敲除小鼠(Ifnar1-/-)建立小鼠模型。这些模型都未能很好的展现血浆渗透、血小板降低、肝肾损害等重症登革热的典型表现。基于此,本研究拟通过小鼠体内传代,获得登革病毒小鼠适应株,感染Ifnar1-/-小鼠建立重症登革热小鼠模型。 |
| 模型制作方法 | 1. 小鼠感染:使用1ml胰岛素注射器分别吸取100 μL病毒液(8×106 Copies/μL),尾静脉接种4-6周Ifnar1-/-小鼠。每日进行称重,观察小鼠临床表现。发病率评分基于Orozco等人描述的1至5的等级:1. 健康;2. 轻度嗜睡;3. 嗜睡、竖毛、弓背;4. 嗜睡、竖毛、弓背、虚弱;5. 垂死。感染后第2、4、6、8天动物眼眶采血,用于血常规检查;分离并冻存血清,用于病毒载量测定;血浆用于细胞因子测定;分批安乐小鼠,采取肠、脾脏、肾脏、肝脏、脑等器官,用于病毒载量检测及组织病理学观察。 2. 病毒载量检测:使用实时荧光定量PCR方法检测小鼠血清和组织中的病毒核酸。简单的,配置反应体系,上下游引物及探针序列分别为DENV-F: 5’-GAR AGA CCA GAG ATC CTG CTG TCT-3’,DENV-R: 5’-ACC ATT CCA TTT TCT GGC GTT-3’, Probe: (FAM)AGC ATC ATT CCA GGC AC (MGB)。Real-time PCR反应条件为:50℃ 30min;95℃ 15min;94℃ 15s;60℃ 60s,40个循环。 3. 全血细胞计数:收集300μL小鼠血液至EDTA抗凝管中,使用爱德士ProCyte Dx* 全自动血细胞分析仪对样本进行血细胞分析。方法如下:首先输入样本编号,选择小鼠物种、类别和模式;其次准备样本:轻轻倒转样本10次,确保其混合均匀;最后将装有样本的采血管放入适配器;然后开始分析。主要分析:红细胞计数(RBC)、红细胞比容(HCT)、血小板计数(PLT)、中性粒细胞计数(NEUT)、淋巴细胞计数(LYMPH)。 4. 组织病理学观察:安乐小鼠,解剖采集肠、脾脏、肝脏、肾脏、脑组织,进行苏木精-伊红(HE染色)。方法简述:组织块经10%的多聚甲醛固定、脱水透明后,置于熔化的石蜡中进行包埋,进而制作石蜡切片;切片脱蜡后进行HE染色;进一步的脱水透明,封片,显微镜下观察。 5. 细胞因子分析:收集300μL小鼠血液至EDTA抗凝管中,分离血浆,进行细胞因子检测。方法简述:1)稀释试剂 ;2)溶解标准品并对倍稀释;3)准备微球,与样本共同孵育;4)洗板;5)加入检测抗体;6)再次洗板;7)加入SA-PE ;8)洗板; 9)上机检测 ;10)结果分析。 |
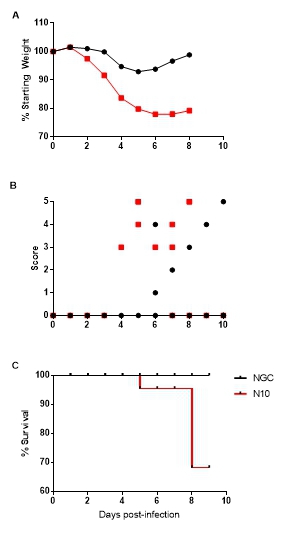
| 模型表型数据 | 1. Ifnar1-/-小鼠感染DENV后的临床表现 为确定NGC株与N10株对小鼠致病性的差别,分别使用NGC株与N10株感染4~6周Ifnar1-/-小鼠,监测小鼠体重变化、疾病症状、致死情况等临床表现。结果显示:两株病毒感染小鼠的体重都在Dpi.2开始下降,Dpi.8 NGC感染组小鼠体重为原始体重的98.8%,而N10感染组小鼠体重为原始体重的79.2%(见图1A)。疾病症状方面,NGC感染组小鼠在Dpi.7出现侧瘫等神经症状;N10株感染小鼠在Dpi.4产生竖毛、虚弱等表现,Dpi.5产生弓背,Dpi.8发生死亡(见图1B、1C),两组具有统计学差异(P<0.01)。结果表明:与NGC株感染小鼠相比,N10株感染小鼠体重下降幅度较大,疾病症状明显,死亡率较高,提示N10株对小鼠的致病性高于NGC株。
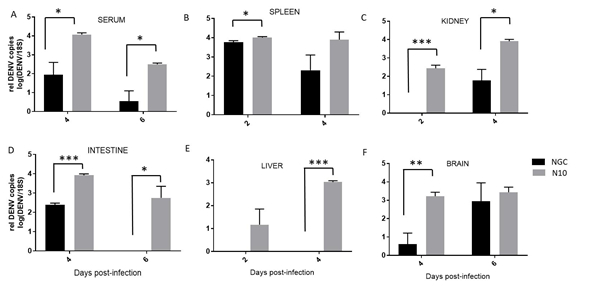
图1 DENV感染小鼠体重变化情况及临床表现 Figure 1 Body weight changes and clinical manifestations of DENV-infected mice 2. Ifnar1-/-小鼠感染DENV后的病毒载量 为确定NGC株与N10株在小鼠体内复制水平的差异,在小鼠分别感染两株DENV后第2、4、6天收集组织(肠、脾脏、肝脏、肾、脑)和血清样本,使用实时荧光定量PCR方法进行病毒载量的检测。结果显示:小鼠血清中,N10感染组在Dpi.6仍可检测到病毒载量,且显著高于NGC株(见图2A)。与其他组织比较,小鼠脾脏中病毒核酸拷贝水平较高,在Dpi.2两组小鼠脾组织病毒载量差异具有统计学意义(见图2B)。在肾脏和肠组织中,NGC株感染的小鼠仅在Dpi.4检测到病毒载量,而N10株感染的小鼠均可检测到病毒载量(见图2C和2D)。在肝脏中,NGC感染的小鼠并未检测到病毒核酸,而N10株感染小鼠在Dpi.2和Dpi.4均检测到病毒核酸,且在Dpi.4有较高的病毒核酸拷贝数(见图2E)。脑组织中,N10株感染小鼠病毒核酸水平高于NGC株感染小鼠。表明N10株在小鼠体内的分布范围明显高于NGC株,维持时间也明显高于NGC株,说明其更能适应小鼠机体。
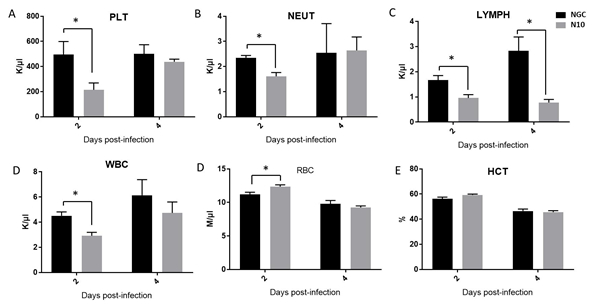
图2 DENV感染小鼠病毒载量水平 Figure 2 Viral load levels of DENV-infected mice 3. Ifnar1-/-小鼠感染DENV后的血常规情况 血小板下降和白细胞下降是人类感染登革热的标志性特征之一,为确定NGC株与N10株对小鼠体内血小板和白细胞水平影响的差异,使用血细胞分析仪进行血常规检查。结果显示:在Dpi.2,与NGC组小鼠相比,N10组小鼠的血小板、白细胞、中性粒细胞、淋巴细胞数均显著降低,具有统计学意义(见图3A-D)。而血细胞比容未见明显差异(见图3E)。N10组小鼠在Dpi.2,红细胞水平高于NGC组。与NGC株感染小鼠相比,N10株感染的小鼠,血小板、白细胞下降水平更显著,说明N10株比NGC株对Ifnar1-/-小鼠的致病力强。
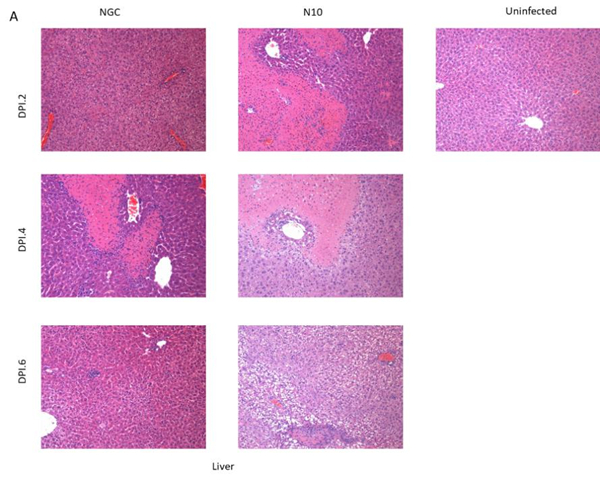
图3 DENV感染小鼠血细胞计数 Figure 3 Complete blood count of DENV-infected mice 4. Ifnar1-/-小鼠感染DENV后的病理学变化 为比较两株DENV对Ifnar1-/-小鼠病理表现的差异,大体解剖发现,肝组织表面有大量坏死灶。将小鼠组织用10%福尔马林固定,苏木精伊红染色(HE染色),进行详细分析。首先,与正常未感染小鼠相比,NGC组所有小鼠脑组织切片在Dpi.6开始观察到脑干、小脑出血、炎性细胞浸润等病理表现。仅有25%的N10组小鼠在Dpi.6出现脑干出血、大脑脑膜血管扩张充血,炎细胞浸润等病理表现。表明N10株相对于NGC株对小鼠的神经毒力下降。其次,在Dpi.6,两组小鼠肾脏中均产生肾小管上皮细胞水肿、空泡变性的病理表现。两组小鼠肠组织内均未见明显病理变化。脾脏组织中,Dpi.2,NGC组小鼠未见明显病理变化,N10组小鼠脾脏有出血,灶性坏死的病理表现。Dpi.4,两组小鼠均有红髓细胞增生的病理表现。Dpi.6,NGC组小鼠髓外造血,N10组小鼠脾脏结构不清晰,红髓大量细胞增生(见图4B)。肝脏组织中,Dpi.2,NGC组小鼠有轻度肝细胞水肿;N10组小鼠表现为灶性凝固性坏死。Dpi.4,NGC组小鼠肝细胞灶性凝固性坏死伴有炎细胞浸润,N10组小鼠产生肝细胞空泡变性和灶性坏死的病理表现。Dpi.6,NGC组小鼠表现为空泡变性,小灶性炎细胞浸润。N10组小鼠表现为灶性坏死和炎细胞浸润(见图4A)。表明:N10株感染小鼠后,病理表现发生了变化,与人类重症登革病理表现趋同。
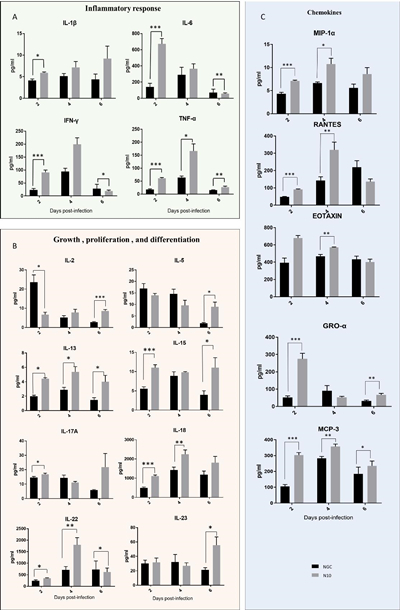
图4 DENV感染小鼠组织病理学变化 Figure 4 Histopathological changes in DENV-infected mice 注:以上均为HE染色结果(100X) 5. Ifnar1-/-小鼠感染DENV后的细胞因子 在重症登革患者观察到细胞因子水平的改变。为比较NGC株与N10株DENV对小鼠细胞因子表达的影响,收集DENV感染后的小鼠血浆,通过Luminex检测多种细胞因子。结果发现,N10组小鼠血浆内的IL-1β、IL-6、IFN-γ、TNF-α等炎症因子水平在Dpi.2显著高于NGC组。Dpi.4,N10组TNF-α急剧增加,高于NGC组,表明Th1细胞介导的炎症反应增强。据报道IL-6和TNF-α水平升高与重症登革相关,因此N10株感染小鼠模型疾病严重程度增加。在Dpi.2,N10组的 IL-13、IL-15、IL-17A、IL-18、IL-22水平均高于NGC组。在感染后的前四天,IL-13、IL-18、IL-22等细胞因子水平逐渐升高。但N10组的IL-2水平低于NGC组。由于Th2细胞分泌的IL-5、IL-6、IL-13等因子主要参与B细胞增殖、分化和抗体产生,因而IL13等因子水平增加,提示与疾病严重程度相关。趋化因子:MIP-α、RANTES、MCP-3等细胞因子水平在感染前四天也呈上升趋势,N10组的表达量高于NGC组。表明:IL-6、IFN-γ、IL-13、IL-22等细胞因子水平升高,可能介导重症登革热的产生。
图5 DENV感染小鼠细胞因子表达水平 Figure 5 Cytokine expression levels in DENV-infected mice |
| 动物模型的评价与验证 | |
| 保存方式 | |
| 合作方式 | |
| 相关文章 | 1.陈 倩,李 丹,佟 巍,蔡方舟,郭 智,鲍琳琳,王 卫. 实时荧光定量RT-PCR方法在登革热小鼠模型中的评估及应用[J]. 中国比较医学杂志,在投。 |
| 备注 |



 京公网安备 11010502043083号
京公网安备 11010502043083号