| 标识符 | CSTR:16397.09.0M02001428 |
|---|---|
| 资源中文名称 | Isca1神经元特异敲除大鼠 |
| 资源英文名称 | SD.Isca1(tm-NeuN-cre)-GC/ILAS |
| 疾病概述 | 多发性线粒体功能障碍综合征(multiple mitochondrial dysfunction Syndrome,MMDS)是一种在临床上死亡率极高的遗传性线粒体疾病,临床症状为神经系统损伤、肌肉张力下降、呼吸功能不全等。MMDS发病机制复杂且并未被阐明,目前没有有效的治疗方案。Isca1基因编码蛋白参与线粒体铁硫簇生物合成中铁的募集和传递,临床发现该基因的纯合突变是MMDS5的致病突变,患者携带Isca1突变。但目前的研究主要集中在临床诊断和病例报告中,缺少致病机制研究和相应动物模型。 |
| 实验动物背景信息 | SD大鼠 |
| 模型制作方法 | 在本实验中,我们利用Isca1flox/flox大鼠和NeuN-Cre大鼠进行杂交,繁育得到Isca1flox/flox-NeuN-Cre大鼠。NeuN-Cre大鼠是将Cre酶的编码序列插入到NeuN基因的下游,使Cre酶与NeuN蛋白共用同一套启动子并有同样的表达模式,而NeuN为神经元特异表达的蛋白,因此只有神经元能转录翻译Cre酶。Cre酶能识别基因组中34bp的flox序列,特异性剪切两个flox序列之间的DNA序列。Isca1flox/flox大鼠是在Isca1基因第三外显子的两端插入flox序列,因此当与NeuN-Cre大鼠杂交后,神经元中的Cre酶会特异性剪切Isca1基因的第三外显子,导致Isca1基因的特异性敲除。 Isca1 flox/+由本实验室在前期构建。NeuN-Cre大鼠来源于国家人类疾病动物模型资源库,编号为CSTR:16397.09.0L02000541。 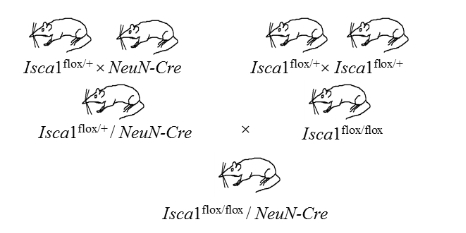 图1 Isca1基因神经元特异性敲除大鼠的繁育策略
|
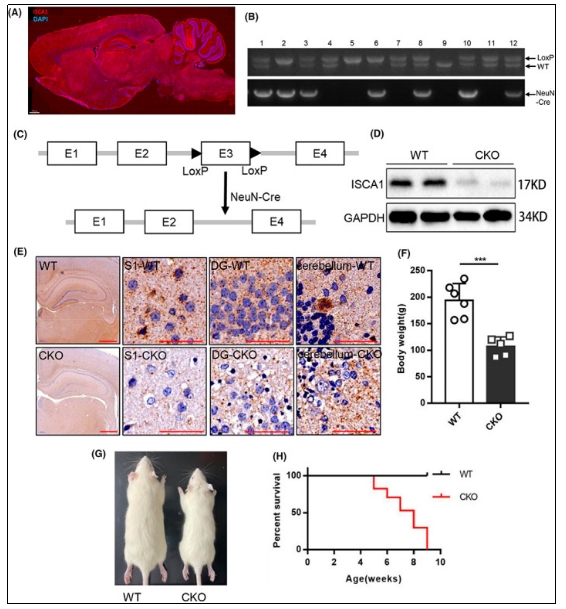
| 模型表型数据 | 1.ISCA1蛋白表达和敲除大鼠的鉴定
为了验证特异性敲除模型构建成功,我们选取6周龄敲除大鼠和WT大鼠,分别提取全脑蛋白和制作石蜡切片,利用Western Blot和免疫组化验证在全脑中ISCA1的缺失和缺失的具体定位。在Western Blot实验中,验证ISCA1敲除效率为72.05%±6.94%,实现了ISCA1在神经系统中的特异性敲除,并通过免疫组化验证神经元胞体中的ISCA1明显减少,说明特异性敲除大鼠模型建立成功。 敲除大鼠从五周龄开始出现死亡,在出生第九周后全部死亡,大多数大鼠在八周龄时死亡,对照的WT大鼠在十周内全部存活。说明神经系统中缺少ISCA1蛋白的大鼠会导致致死性的神经系统疾病。
图1 敲除大鼠的建立和鉴定 2.Isca1 敲除导致大鼠脑结构改变
根据临床病例的报道,MMDS5患者脑结构有明显改变,具体为脑室扩张、白质异常等,我们利用磁共振成像技术观察活体大鼠的脑结构变化。 通过对四只六周龄敲除大鼠和四只同笼WT大鼠大脑和小脑体积的定量,发现敲除大鼠的大脑、小脑体积分别明显减少,小脑的萎缩尤为明显。通过高信号划定脑室的范围,发现敲除大鼠侧脑室体积明显增加,存在异常扩张。而且T2图像显示敲除大鼠在海马槽、海马裂有明显异常高信号,可能是海马病变和脑萎缩导致的炎症或积水导致的。解剖观察敲除大鼠的小脑体积明显偏小,大脑体积有略微减少,这与磁共振成像的结果相吻合。
图2 MRI检查敲除大鼠脑结构改变 3.I. Isca1 敲除大鼠发生行为异常
3.1. Isca1 敲除大鼠发生癫痫
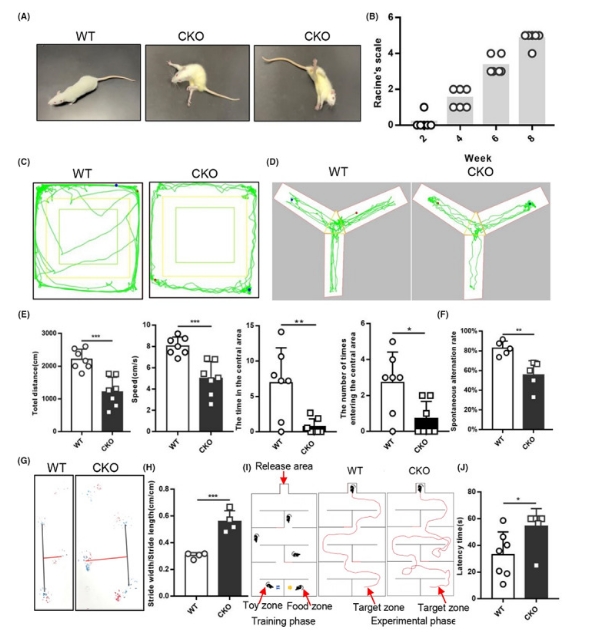
通过持续的观察发现,大多数敲除大鼠在离乳前未见明显异常,从四周龄开始出现疾病表型,先是后肢从一侧到双侧的运动无力,重心不稳;然后发展到行进跌倒,无法保持自身平衡,偶有自发的不自主运动如一侧后肢痉挛的发生,持续时间约为5-10s;最终无法站立,身体扭曲,背部躬起,姿势异常,四肢痉挛抽搐,间隔时间随发病进程逐步缩短,发病后期间隔时间仅为30s左右,通常在8-9周龄死亡。 在2周龄、4周龄、6周龄、8周龄分别通过Racine’s scale对WT大鼠和敲除大鼠的癫痫行为进行评价,结果显示,WT大鼠评分为0,无癫痫的表现,但敲除大鼠评分为Ⅳ或Ⅴ级,有较强的癫痫发作。敲除大鼠与临床MMDS5患者的症状相同,可以较好的模拟人类疾病。 3.2. Isca1 敲除大鼠步态异常和自发运动减少
在6周龄对大鼠进行步态实验,与WT大鼠相比,敲除大鼠的步宽/步长明显增加,提示出现明显的运动协调缺陷,并且出现的根骨着地的现象,提示其后肢无力,运动障碍。 在旷场实验中,敲除大鼠的运动距离和运动速度相比WT大鼠有明显下降,提示敲除大鼠的运动功能有一定障碍;而且敲除大鼠进入中心区探索的时间和次数均降低,提示敲除大鼠存在焦虑和恐惧的心理。这一结果提示敲除大鼠运动功能有一定的损伤,对中心区探索的减少在一定程度是焦虑、恐惧心理的体现。 图3 行为学检测Isca1 敲除大鼠的运动和认知改变 3.3. Isca1 敲除大鼠发生记忆功能障碍 Y迷宫自主交替实验的结果显示,WT大鼠的正确自主交替率为82.64%±7.19%,敲除大鼠的正确自主交替率为55.54%±14.48%,敲除大鼠的正确率明显降低(P=0.006);而且通过观察敲除大鼠的轨迹,我们发现敲除大鼠出现在中央区短暂探索后重复进入某一个通道的情况,在WT大鼠中没有此类情况,提示其短期记忆的严重障碍。可以得出敲除大鼠的探索欲望与工作记忆明显降低的结论。 鉴于敲除大鼠出现运动功能的障碍,在水迷宫实验中无法做到单一变量,且敲除大鼠有溺亡的风险,不适合进行运动量较大的水迷宫实验,因为我们设计了一种食物迷宫实验,可弥补在水迷宫实验中有部分运动障碍的大鼠无法正常游泳而影响实验结果的缺陷。如示意图所示,利用大鼠对食物的本能需求,来评价大鼠在长时间内的空间位置记忆能力。实验结果显示,野生大鼠能在进入迷宫后,沿正确路径快速找到食物且不进入错误区域,找寻时间平均值为32.7s,但敲除大鼠出现在既定时间(1分钟)内找不到食物区域或进入错误区域后才找到食物的现象,找寻时间为54.5s(P=0.008)。潜伏期明显增加,提示敲除大鼠的长期记忆出现障碍。 3.4. Isca1 敲除导致大、小脑组织空泡化病理损伤
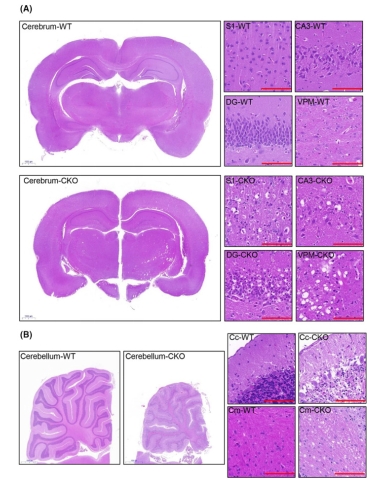
我们进一步利用Isca1敲除后建立的MMDS累及神经系统疾病的大鼠,研究在目前病例报道中尚未报道的病理变化和表型通过H&E染色发现敲除大鼠在多个脑区都出现病变,在大脑皮层的第一躯体感觉皮质(S1)区、海马的CA3和DG区和丘脑腹后内侧核(VPM)区均有明显变化。神经元严重变性,细胞数量明显减少,锥体神经元排列严重紊乱,细胞肿胀和核固缩,胞浆空亮,形成大量空泡。在小脑中,皮质的浦肯野细胞和颗粒细胞有大量的丢失,可以在皮质区域和髓质区域观察到明显的空泡。
图4 H&E染色观察敲除大鼠脑区显微结构变化 3.5. Isca1敲除导致神经元丢失、尼氏小体减少
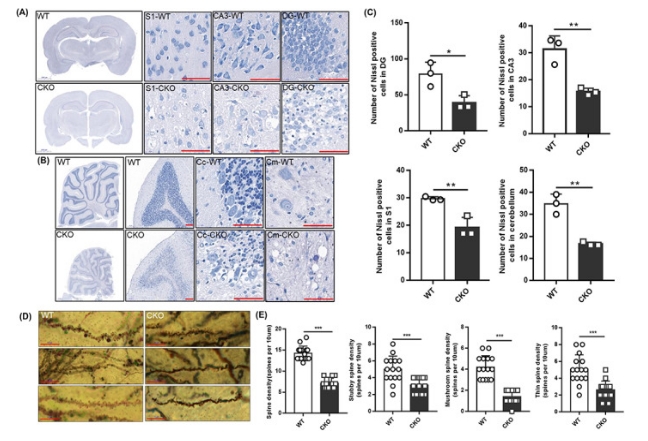
为进一步探究神经元功能具体的变化,我们通过经典的神经生物学研究技术Nissl染色和Golgi染色分析神经元功能和结构变化。尼氏体的形态结构可作为判定神经元功能状态的一种标志。整体上敲除大鼠的染色明显变浅,提示尼氏小体数量的整体减少。高倍镜下观察发现, WT大鼠大脑皮层S1区神经元排列有序、染色均匀,而敲除皮层S1区神经元排列紊乱,部分神经元细胞核外无尼氏小体,细胞出现空泡化,嗜碱性的细胞核染色并不均匀,核内物质消失;WT大鼠海马CA3区神经元完整,胞质中尼氏小体丰富,染色较深 而敲除大鼠海马CA3区神经元不完整,细胞核外尼氏小体明显减少,细胞出现空泡;WT大鼠海马DG区神经元排列有序的、胞体大小一致,而敲除神经元无序排列,出现大量细胞核固缩,细胞肿胀,空泡化,无明显形态特征。通过对神经元的计数,发现在不同脑区神经元的数量也有所减少。综上,不仅是神经元出现了死亡,尚存的神经元生物代谢活动也受到严重损伤。
图5 尼氏染色和高尔基染色观察敲除大鼠脑组织神经元数量和结构的改变 3.6. Isca1敲除导致线粒体结构和功能异常
为了进一步研究Isca1敲除后对线粒体的影响,我们通过TEM观察线粒体的结构,通过Western Blot检测呼吸链中重要蛋白的含量,并通过试剂盒检测ATP的含量。 在透射电镜实验中,我们根据H&E染色中严重病变的区域,选择六周龄大鼠的海马区域作为研究对象。结果显示,WT大鼠的线粒体结构正常,具有清晰的边界和嵴,在敲除大鼠神经元的线粒体中有多处异常。在总体线粒体形态中,线粒体重度肿胀,体积增大,质地变空;在膜内物质中,线粒体基质颗粒消失,嵴结构断裂,线粒体内腔出现嵴断裂的蛋白崩解产物;在线粒体膜中,线粒体膜损伤破裂。因此,ISCA1蛋白的缺失会导致线粒体结构的严重受损。 为进一步探索线粒体中主要发挥功能和产生ATP的电子传递链功能的改变,我们利用Western Blot分析电子传递链中主要蛋白的含量变化。结果显示,线粒体呼吸链复合物I亚基NDUFA9、NDUFS3,复合物Ⅱ亚基SDH B的蛋白含量有明显变化,而ACO2、UQCRC2、COXⅣ变化并不明显.这与ISCA1主要影响线粒体中[4Fe-4S]簇的生物合成,复合体Ⅰ和复合体Ⅱ需要[4Fe-4S]簇,而复合体Ⅲ需要[2Fe-2S]簇相一致。此外,ATP含量检测的结果显示,敲除大鼠脑组织中的ATP含量较WT脑降低39%,进一步证实了线粒体功能的损伤。 综上,ISCA1蛋白的缺失通过影响[4Fe-4s]的生物合成,影响铁硫蛋白的正常组装和发挥生理功能,进而导致ATP生成的减少和线粒体结构的损伤,最终导致整个线粒体的病变损伤神经系统。
图6 电镜观察线粒体结构以及western blotting检测线粒体呼吸链相关蛋白的表达 3.7. Isca1敲除导致大鼠神经元胀亡
鉴于H&E染色中观察到明显的细胞空泡化提示细胞出现肿胀,结合因ATP生成减少导致细胞膜上以Na泵为主的多种离子泵缺少能量来源导致功能降低,无法维持正常的细胞内外渗透压,导致细胞外溶质内流,细胞肿胀坏死。因此我们推测由ISCA1缺失导致神经元死亡的方式是细胞胀亡。 我们通过免疫荧光染色对大脑冠状面和小脑矢状面进行染色,验证细胞的形态变化,用偶联Texas红的小麦胚芽凝集素(wheat germ agglutinin, WGA)来指示细胞膜,用含DAPI的封片剂标记细胞核。 WT大鼠海马区域可观察到排列整齐有序的神经元结构,细胞膜完整;敲除大鼠神经肿胀,排列无序,细胞膜缺失。通过统计不同脑区中多个视野中空泡的数量,海马区(A)、皮层(C)和小脑(E)中的空泡数量明显增加。以上结果提示,由ISCA1缺失导致的神经元死亡方式为不同于程序性细胞凋亡(细胞固缩)的细胞胀亡引起。
图7 WGA染色观察敲除大鼠脑组织神经元的病理改变 |
| 动物模型的评价与验证 | 1 动物模型基因型鉴定 Isca1-flox的基因型检测采用引物5′ATGGTTCCAGCACT TTGAAGG 和引物5′ AAGCTAATATGACAGTG GTGAGGC进行PCR鉴定。NeuN-cre的基因型鉴定采用引物5′CCTCT CAGATGTTGGAACTCTCT 和 5′GTGCCTTCTCTACACCTGCG进行PCR鉴定。 Icas1flox/flox 纯合子和Cre 阳性动物为敲除大鼠。 2 WB和IHC评价该基因在敲除大鼠的蛋白表达水平 提取仔代大鼠大脑组织总蛋白,进行免疫印迹,确认Isca1在脑组织蛋白中表达缺失。 3 生存率情况 敲除大鼠从5周龄开始出现死亡,在出生第9周后全部死亡,大多数大鼠在8周龄时死亡,对照的WT大鼠存活率正常。 4大脑形态解剖观察 MRI和解剖观察均发现,大鼠的大脑、小脑体积分别明显减少,小脑的萎缩尤为明显。 5 行为学测试 敲除大鼠4周龄后肢发生异常,运动无力,步态异常,自发活动减少,随后可发展为癫痫。Y迷宫中WT大鼠的自发交替率为82.64%±7.19%,敲除大鼠的自发交替率为55.54%±14.48%,和野生型比,自发交替率显著降低(P=0.006),提示工作记忆障碍;食物迷宫测试中,敲除鼠找到食物的潜伏期明显增加,提示敲除大鼠的长期记忆出现障碍。 |
| 保存方式 | 冷冻 |
| 合作方式 | 不限定 |
| 相关文章 | Sheng H, Lu D, Qi X, Ling Y, Li J, Zhang X, Dong W, Chen W, Gao S, Gao X, Zhang L, Zhang L. A neuron-specific Isca1 knockout rat developments multiple mitochondrial dysfunction syndromes. Animal Model Exp Med. 2023 Apr;6(2):155-167. |
| 备注 |





 京公网安备 11010502043083号
京公网安备 11010502043083号