| 标识符 | CSTR:16397.09.0M02001427 |
|---|---|
| 资源中文名称 | Tspan7基因敲除大鼠 |
| 资源英文名称 | Wistar.Tspan7(tm)-GC/ILAS |
| 疾病概述 | 自闭症谱系障碍(Autism Spectrum Disorder, ASD),也称孤独症(autistic disorder)谱系障碍,是一种广泛性发展障碍(pervasive developmental disorder,PDD)的一种代表性疾病,现多使用于儿童身上。其病征包括异常的语言能力、异常的交往能力、狭窄的兴趣以及固执刻板的行为模式。临床诊断依据是核心行为异常包括社交障碍和陈规定型行为。儿童自闭症是儿童精神类疾病当中最为严重的一种。 孤独症的患病率报道不一,2005年报道称10000人中约有60人患病,2007年,110名儿童就有1人患病,男孩比女孩更为常见,男女比例约为3~4:1,男孩比女孩。目前中国的孤独症患者可能超过1000万,0~14岁患者或超200万,并以每年近20万的速度增长。自闭症的病因至今仍然不明,也没有有效药物能够治愈,世界公认的可以改善自闭症症状的只有“科学干预”。 自闭症的成因极为复杂,可能是涉及遗传学因素、免疫因素、生化因素、孕产期因素等,造成了特定脑结构或脑功能的损伤所致。至于损伤的具体脑区、分子机制如何,仍待进一步研究。 |
| 实验动物背景信息 | Wistar大鼠 |
| 模型制作方法 | 1. 实验材料 1.1 实验动物 Wistar大鼠购自北京维通利华实验动物技术有限公司和北京华阜康生物科技股份有限公司。 1.2 主要实验仪器 Nikon显微注射仪 Nikon光学显微镜 BIO-RAD电泳仪 Tanon电泳槽 Tanon数码凝胶图像处理系统 Incucell恒温培养箱温控 TAITEC振荡箱 Eppendorf离心机 Eppendorf移液器 2.实验操作规程和动物处理伦理 模型制作中涉及动物的操作程序已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为MYW22004,简要步骤如下: 2.1 供卵雌鼠超排 实验第一天8:00 腹腔注射PMSG 30IU/只(0.6ml/只),46~48h以后,实验第三天10:00 腹腔注射HCG 30IU/只(0.6ml/只),注射HCG后立即与与种鼠1:1合笼。实验第四天8:00~9:00检查阴道栓,有阴道栓的大鼠在大鼠标牌上注明日期和⊕(阳性),捡出有阴栓的大鼠进行受精卵的收集。 2.2 受精卵的收集 2%戊巴比妥钠麻醉大鼠,脱颈处死,解剖大鼠,找到卵巢,输卵管和子宫,将卵取出,用透明质酸酶消除胚泡的黏着,使卵分离。在移换到另外的培养液中,要将透明质酸酶充分洗净(洗约3~5次)。 2.3 向受精卵雄性原核注入DNA溶液 2.4. 仅将未损坏的完成操作的卵收集起来,移植到假妊娠大鼠输卵管中。术后将大鼠置于安静的环境下饲养。 2.5 基因表型鉴定 在判定有导入基因大鼠之后,立即将基因修饰大鼠另行饲养,对不用的大鼠进行处理。阴性大鼠的处理:(1)留和阳性大鼠等量的阴性大鼠对照。(2)剩余的阴性大鼠用于其它符合动物伦理的其他实验室的实验(保存记录)。 3.基因敲除靶点设计与基因型鉴定 利用CRISPR/Cas9 技术建立基因敲除大鼠,sgRNA 的作用靶点位于第2外显子,包括sgRNA 1(CCACCATGGTGGGCATGTACT) 和 sgRNA2 (CCTGGCACAGTAAACAGAGTC)。Cas9 蛋白 (30 ng/μL), sgRNAs (10 ng/μL)混合物进行显微注射,获得基因编辑大鼠。使用引物1:5’GCAAACTACCACATCATTCCCAG-3’,和引物2:5’CTGTGTCCATCAGCTCAGATCAG-3’进行基因型鉴定。 |
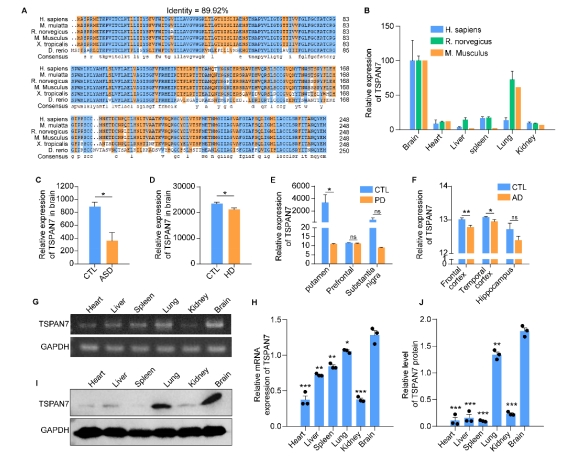
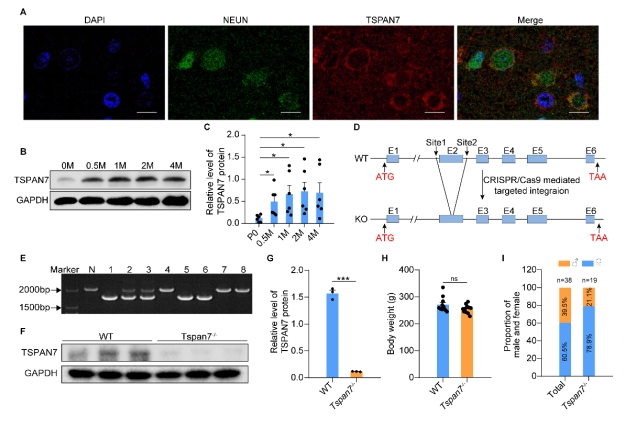
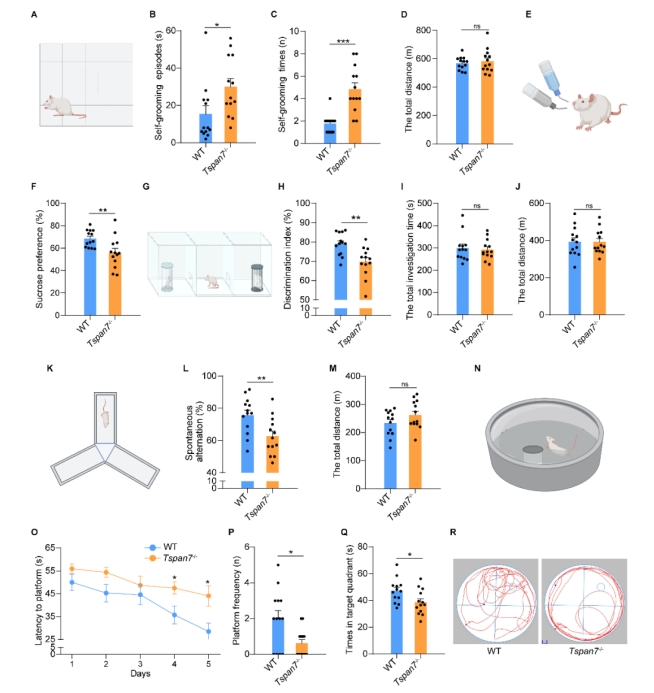
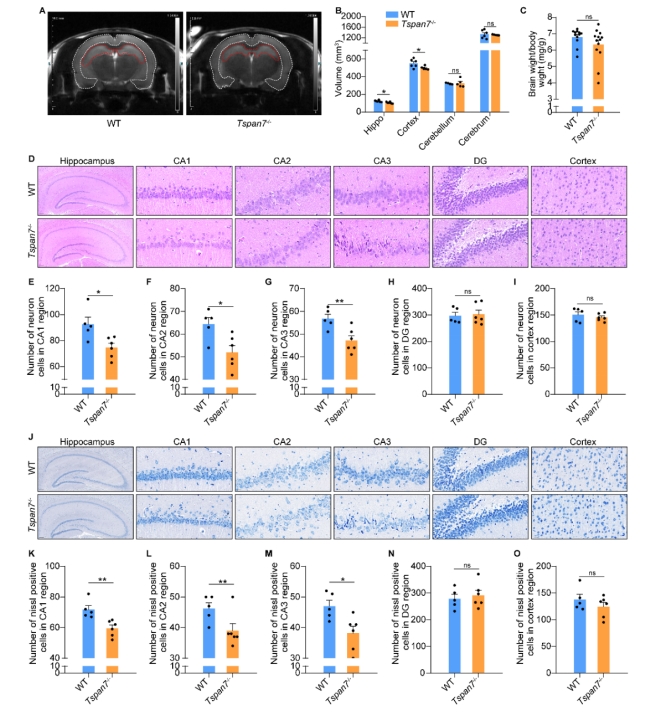
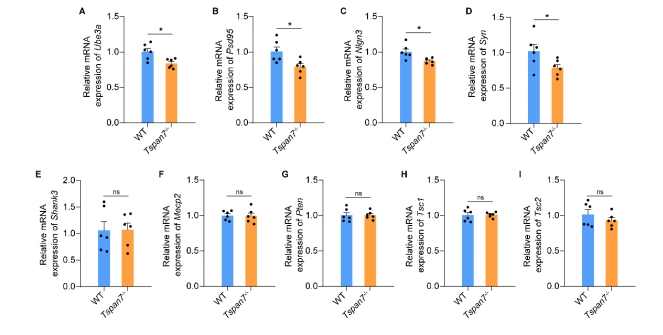
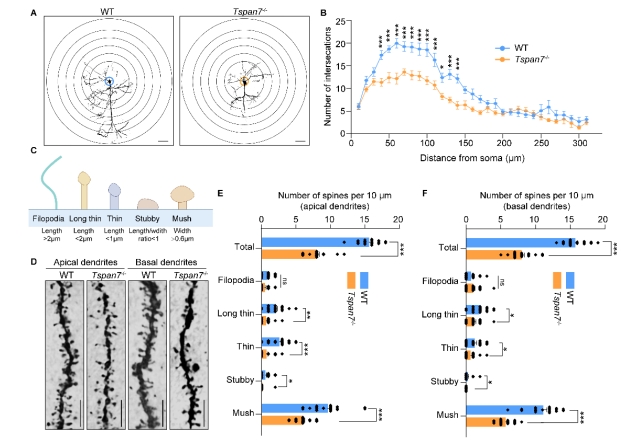
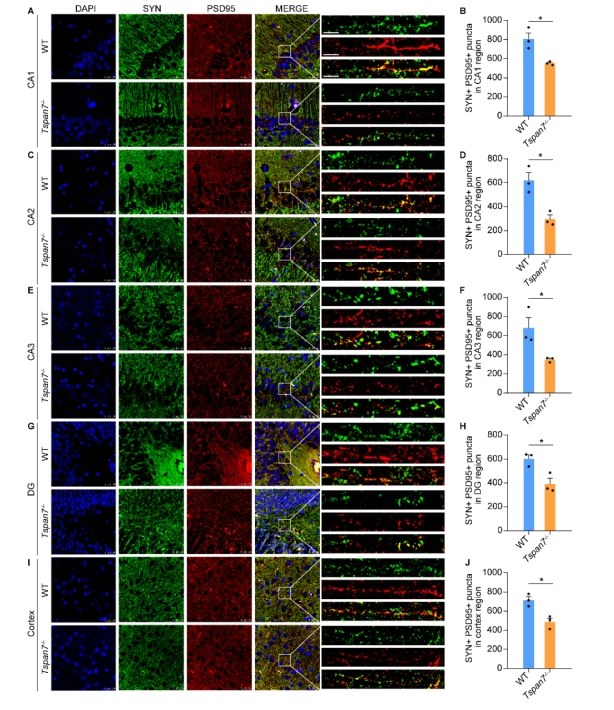
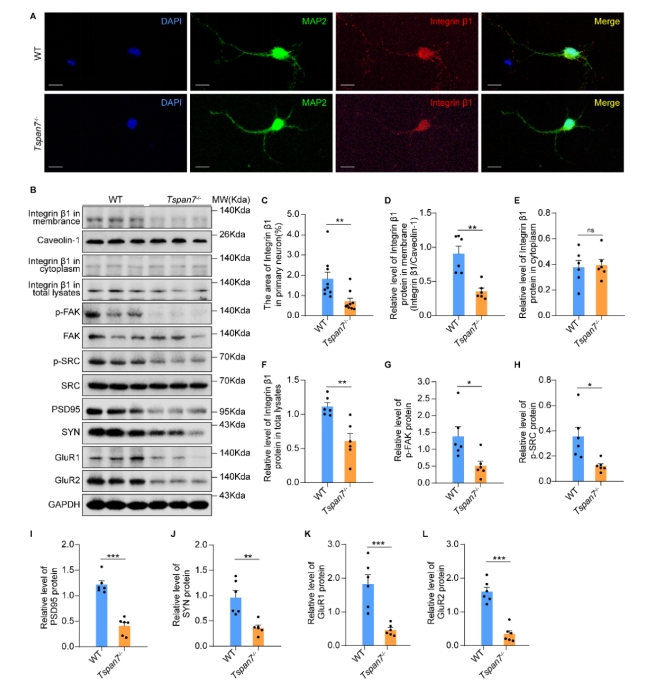
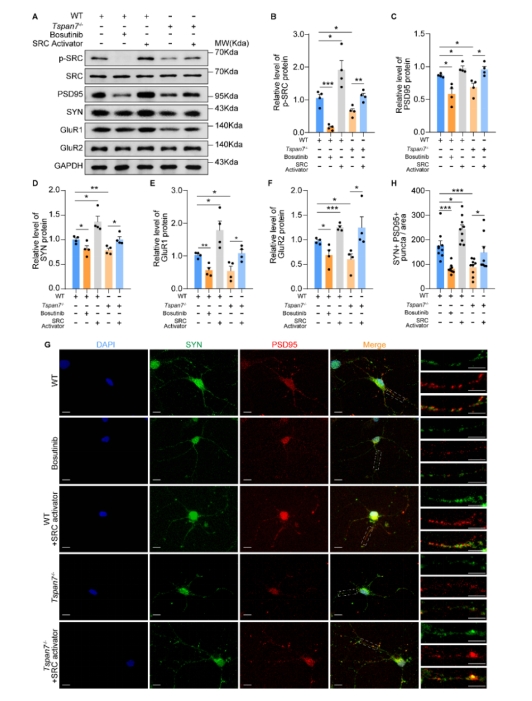
| 模型表型数据 | 1. TSPAN7在病理和生理条件下的组织表达 TSPAN7在进化上非常保守,将人、猴、大、小鼠、爪蟾和斑马鱼的TSPAN7蛋白进行氨基酸比对,其序列同源性高达89.2%(图1A)。Genebank数据库显示,TSPAN7蛋白在人、大小鼠的组织表达模式类似(图1B),均是在脑、肺中高表达,在心、脾、肾、肝组织中低表达。GEO数据库数据显示,TSPAN7蛋白在ASD、HD、PD和AD病人脑组织中表达均显著下调(图1C-F)。RT-PCR和western blot实验验证了TSPAN7蛋白的组织表达模式(与数据库一致)(图1G-J)。 图1 TSPAN7在病理和生理条件下的组织表达分析 2. TSPAN7敲除大鼠的建立和蛋白表达鉴定 免疫荧光分析显示TSPAN7蛋白在NEUN标记的神经细胞表达(Fig.2A)。免疫印迹结果表明了TSPAN7蛋白的时间表达模式:在出生时低表达,随后2周到4月龄期间均高水平表达(Fig.2B&C)。利用CRISPR/Cas9 技术建立基因敲除大鼠,两个sgRNA 的作用靶点位于第2外显子(Fig.2D)。基因组测序显示,第2外显子的序列和部分第2内含子的序列共546bp被删除,最终得到两个首建鼠,其中一个稳定传代后用于后续实验。PCR鉴定后代基因型,序列删除导致TSPAN7蛋白表达缺失,免疫印迹验证其表达缺失(Fig.2E-G)。成年TSPAN7敲除大鼠与野生型大鼠体重并无明显差异,但是雌雄比例差别较大(Fig.2H&I)。 图2 TSPAN7在脑组织的表达,以及TSPAN7敲除大鼠的建立鉴定 3. TSPAN7敲除大鼠表现出ASD样行为 开放旷场中,TSPAN7敲除大鼠与野生型相比,在同等时间里,运动总距离无差异,但是自我梳理时间和次数均显著增加(Fig.3A-D)。糖水实验中,TSPAN7敲除大鼠与野生型相比,糖水摄取下降6.7%(Fig.3E&F)。三箱社交实验中,TSPAN7敲除大鼠与陌生大鼠互动的时间明显减少,但总体运动距离和探索时间不变(Fig.3G-J)。Y迷宫测试中,TSPAN7敲除大鼠的自发交替次数减少,反映大鼠工作记忆受损(Fig.3K-M)。水迷宫测试中,TSPAN7敲除大鼠的学习能力下降,空间探索记忆受损(Fig.3N-R)。 图3 TSPAN7敲除大鼠的行为学分析 4 病理学分析 核磁影像检查TSPAN7敲除大鼠脑结构变化,统计结果表明敲除大鼠脑皮层体积和海马体积均显著下调,同时大小脑总体积变化不显著, 脑重/体重比无差异(Fig.4A&B&C)。HE染色显示海马大体结构变化不明显,但是统计分析,锥体神经元数量下降,尤其是CA1, CA2和 CA3区。DG区和皮层的锥体神经元数量变化不显著(Fig.4D-I)。采用甲苯胺蓝进行尼氏体染色,统计分析结果与HE统计结果一致,敲除大鼠CA1, CA2和 CA3区锥体神经元数量下降(Fig.4J-O)。 图4 TSPAN7敲除大鼠的脑病理分析 5. TSPAN7敲除导致大鼠脑组织中自闭症相关基因表达减少 为了探索TSPAN7涉及的分子事件,RT-PCR检测了Shank3, Mecp2, Pten, Tsc1,Tsc2,Ube3a, PSD95, Nlgn3和Syn 等9个ASD相关基因在脑组织表达变化。结果显示,Ube3a, PSD95和Nlgn3在TSPAN7敲除导致大鼠脑组织中表达显著下调(Fig.5A&B&C),其它6个基因表达无变化(Fig.5D-I)。 图5 TSPAN7敲除大鼠脑组织中自闭症相关基因表达检测 6. TSPAN7敲除大鼠脑神经元树突复杂性下降,树突棘密度降低,突触结构蛋白表达减少 为了探索TSPAN7敲除是否对神经元形态及树突棘产生作用,使用高尔基染色对海马、皮层神经元进行分析。结果显示,TSPAN7敲除大鼠脑神经元树突分支减少、变短,复杂度降低(Fig.6A&B)。树突棘总数分析,TSPAN7敲除大鼠脑神经元树突棘密度下降。树突棘分型分析显示,瘦长型、瘦型、蘑菇型及短粗型树突棘数量下降,而丝状伪足型数量变化不明显(Fig.6C-F)。PSD95和Synaphysin蛋白双色免疫荧光标记脑切片中神经元突触前后结构,结果表明TSPAN7敲除大鼠脑突触结构蛋白表达减少,提示突触受损(Fig.7A-J)。 图6. TSPAN7敲除大鼠脑组织Golgi染色及统计分析 图7. TSPAN7敲除大鼠脑组织PSD95和Synaphysin蛋白免疫荧光染色及统计分析 7. TSPAN7敲除导致大鼠脑组织中Integrin β1/FAK/SRC信号下调 免疫荧光染色显示,Integrin β1在神经元细胞表达,TSPAN7敲除导致表达减少(Fig.8A)。原代神经元细胞总蛋白及膜成分、胞浆成分分别进行western blot分析,结果提示TSPAN7敲除导致Integrin β1在细胞膜成分中表达减少,胞浆中无差异(Fig.8B-F)。Src已被证明在突触传递和突触可塑性中起重要作用,且有报道Integrin β1与SRC互作。因此我们对Src其下游的信号进行检测,结果提示FAK及SRC也由于Integrin β1的减少而磷酸化水平显著降低(Fig.8B&G&H)。进一步,PSD95, SYN, GluR1和GluR2等下游蛋白表达被显著抑制(Fig.8B, I-L)。 图8. TSPAN7敲除大鼠脑组织中信号通路分析 8. TSPAN7敲除大鼠原代神经元Integrin β1/FAK/SRC信号通路分析 TSPAN7敲除大鼠脑组织中Integrin β1/FAK/SRC信号下调,为了进一步验证这一结果。我们分离原代神经元细胞进行信号的验证。我们还是用了SRC信号抑制剂(Bosutinib)和激活剂(EPQpYEEIPIYL)刺激野生型原代神经元,同时使用激活剂(EPQpYEEIPIYL)处理敲除大鼠原代神经元,进而检测下游信号及突触相关蛋白的变化。结果显示,野生型细胞SRC抑制剂可显著下调src信号并降低PSD95、SYN蛋白的表达,敲除细胞src下调同时降低PSD95、SYN蛋白的表达,激活剂添加在野生型和敲除细胞上均可以激活或者逆转src信号下调及增加突触相关蛋白的表达(Fig.9A-F)。免疫荧光也确认了突触相关蛋白PSD95、SYN受到抑制剂或者基因敲除的下调,以及激活剂的上调(Fig.9G&H)。综合以上结果,提示TSPAN7敲除通过下调SRC信号通路降低突触结构蛋白的表达。 图9. TSPAN7敲除大鼠原代神经元信号通路分析和突触结构蛋白分析 |
| 动物模型的评价与验证 | 1 动物模型基因型鉴定 使用引物1:5’GCAAACTACCACATCATTCCCAG-3’,和引物2:5’CTGTGTCCATCAGCTCAGATCAG-3’进行PCR鉴定基因型。 2 WB和IHC评价该基因在敲除大鼠的蛋白表达水平 提取仔代大鼠大脑组织总蛋白,进行免疫印迹,确认TSPAN7在脑组织蛋白中表达缺失。 3 生存率情况 野生型和敲除大鼠,观察7月龄内死亡情况,二者并无明显差异。只是出生率稍低,平均每窝7.6只,低于野生鼠平均值10-11。 4大脑形态解剖观察 核磁影像检查TSPAN7敲除大鼠脑结构变化,统计结果表明敲除大鼠脑皮层体积和海马体积均显著下调,同时大小脑总体积变化不显著, 脑重/体重比无差异(Fig.4A&B&C)。HE染色显示海马大体结构变化不明显,但是统计分析,锥体神经元数量下降,尤其是CA1, CA2和 CA3区。DG区和皮层的锥体神经元数量变化不显著(Fig.4D-I)。采用甲苯胺蓝进行尼氏体染色,统计分析结果与HE统计结果一致,敲除大鼠CA1, CA2和 CA3区锥体神经元数量下降(Fig.4J-O)。 5 行为学测试 TSPAN7敲除大鼠表现出ASD样行为。开放旷场中,TSPAN7敲除大鼠与野生型相比,在同等时间里,运动总距离无差异,但是自我梳理时间和次数均显著增加(Fig.3A-D)。糖水实验中,TSPAN7敲除大鼠与野生型相比,糖水摄取下降6.7%(Fig.3E&F)。三箱社交实验中,TSPAN7敲除大鼠与陌生大鼠互动的时间明显减少,但总体运动距离和探索时间不变(Fig.3G-J)。Y迷宫测试中,TSPAN7敲除大鼠的自发交替次数减少,反映大鼠工作记忆受损(Fig.3K-M)。水迷宫测试中,TSPAN7敲除大鼠的学习能力下降,空间探索记忆受损(Fig.3N-R)。 |
| 保存方式 | 活体 |
| 合作方式 | 不限定 |
| 相关文章 | Pang S, Luo Z, Dong W, Gao S, Chen W, Liu N, Zhang X, Gao X, Li J, Gao K, Shi X, Guan F, Zhang L, Zhang L. Integrin β1/FAK/SRC signal pathway is involved in autism spectrum disorder in Tspan7 knockout rats. Life Sci Alliance. 2022 Dec 20;6(3):e202201616. doi: 10.26508/lsa.202201616. PMID: 36625203; PMCID: PMC9768919. |
| 备注 |


 京公网安备 11010502043083号
京公网安备 11010502043083号